磷是影响水体富营养化的关键因素之一,过量的磷会造成水体富营养化,破坏水体中的生态环境,影响人类健康和水生生物生长. 随着人为活动产生的大量含磷污水排入,受纳水体富营养化程度日益严峻. 因此,污水中磷的去除越来越受到关注. 吸附法是利用对磷具有较强吸附能力的材料,通过在材料表面与磷酸盐之间发生的物理、化学吸附等反应把磷从水中分离去除,具有高效、迅速、适应性强、易操作以及无二次污染等优点,是应用前景较好的一种除磷方法(shannon et al., 2008; qu,2008). 吸附剂是吸附技术的关键,寻求廉价、高效的吸附剂始终是国内外环境研究者关注的重点和热点.
近年来,合成类金属氧化物如铝氧化物(tanada et al., 2003)、铁氧化物(zeng et al., 2004)、锰氧化物(mustafa et al., 2006)以及稀土氧化物(guo et al., 2011)等对磷具有较强的吸附性与选择性,越来越受到重视. 进一步研究表明,把两种或两种以上金属氧化物结合在一起,制备出铁锰(zhang et al., 2009)、铁锆(ren et al.,2012)、铁铝(de sousa et al.,2012)、铁钇(李国亮等,2012)、铁铜(li et al., 2014)等系列复合氧化物,不仅可继承母体组分的优点,且组分间相互取长补短,具有显著的协同效应,与单一金属氧化物相比,具有更好的磷吸附性能,为强化除磷提供了经济高效的新型吸附材料.
然而,制备的吸附剂往往是粉末状,在实际应用中难以固液分离,且不适用于吸附柱内使用,限制了吸附剂的应用范围. 因此,为了便于实际工程应用,有必要把粉末金属复合氧化物进行固定化. 将吸附材料负载于固体颗粒物(如石英砂、滤料等)表面的包覆改性法是目前常用的一种经济有效的吸附剂固定化方法(ayoub et al., 2001; arias et al., 2006).
前期研究表明铁锰复合氧化物作为磷吸附剂,具有吸附量高、环境友好、ph适用范围广等优点(zhang et al., 2009). 为了充分发挥铁锰复合氧化物的磷吸附性能,本文选用资源丰富、价格低廉的海砂为负载材料,开展铁锰复合氧化物包覆海砂制备、表征及其磷吸附特征研究,以期实现粉末状铁锰复合氧化物吸附剂的固定化,进一步扩大铁锰复合氧化物吸附材料的应用范围,为污水除磷提供一种新型颗粒状吸附剂.
2 材料与方法
2.1 实验试剂与仪器
材料: fecl3 · 6h2o、feso4 · 7h2o、kmno4、hno3、naoh、nano3等化学试剂均为分析纯; kh2po4为优级纯; 海砂为烟台市当地海砂,颗粒大小取40~80目,简记为os; 磷储备液由kh2po4溶于去离子水制得,实验时用去离子水稀释到指定浓度.
仪器: hzq-c调速多速恒温振荡器,dh-201型电热恒温干燥箱,tu-1810型紫外可见分光光度计,奥立龙3 star型台式ph计.
2.2 铁锰复合氧化物包覆海砂的制备
2.2.1 铁锰复合氧化物的制备
铁锰复合氧化物采用氧化还原/共沉淀法制备(zhang et al., 2009): 以fecl3 · 6h2o、feso4 · 7h2o与kmno4为原料,三者物质的量比为3 ∶ 3 ∶ 1. 向kmno4溶液中加入一定量的naoh溶液至溶液呈碱性,然后在快速搅拌条件下把kmno4溶液逐滴加入fecl3 · 6h2o与feso4 · 7h2o 混合溶液中,加毕,继续搅拌30~60 min,静置陈化后,倾倒出上清液,用去离子水洗涤悬浮物3~4次,得到的固体物即为铁锰复合氧化物.
2.2.2 铁锰复合氧化物包覆海砂的制备
将用去离子水清洗、干燥后的海砂加入制备的铁锰复合氧化物中,搅拌1 h,过滤,55 ℃干燥12 h,得到铁锰复合氧化物包覆海砂,简记为cs.
2.3 铁锰复合氧化物包覆改性海砂的表征
2.3.1 铁锰复合氧化物含量测定
准确称取定量的海砂和包覆海砂,加入过量的饱和草酸溶液,200 r · min-1震荡24 h后,将溶液过0.45 μm醋酸纤维膜,用icp-oes法测定溶液中铁、锰的浓度,计算海砂与包覆海砂中铁、锰的含量以及铁锰复合氧化物的含量.
2.3.2 比表面积测定
分别取海砂与包覆海砂,通过beishide3h-2000iii氮吸附比表面测量仪测定颗粒的bet比表面积.
2.3.3 sem表征
分别取海砂和包覆海砂,干燥后表面喷涂一层金属箔膜,置于hitachi s-4800高分辨率扫描电镜下进行表面形貌观测.
2.3.4 edax表征
分别取海砂与磷吸附前后的包覆海砂,干燥后直接置于hitachi s-4800高分辨率扫描电镜下进行edax能谱分析.
2.4 磷吸附实验
吸附试验在(25±0.1)℃,200 r · min-1的振荡器中振荡24 h,前6 h每2 h调1次ph,后18 h调2次ph,使ph稳定,背景电解质为nano3(0.01 mol · l-1),吸附剂浓度为4 g · l-1. 吸附完成后样品过0.45 μm醋酸纤维素膜,采用钼锑抗分光光度法测定磷浓度.
2.4.1 吸附等温线
配制一系列50 ml的不同初始磷浓度(0~20 mg · l-1)溶液,分别投加200 mg吸附剂,每隔一段时间调一次ph,使ph稳定在5.0±0.1(7.0±0.1),吸附后,取样、过膜、测定磷浓度.
2.4.2 吸附动力学
在1.0 l磷浓度分别为3.0与6.0 mg · l-1的两种溶液中进行,吸附剂的投加量为4.0 g,ph为5.0±0.1. 每隔一段时间取样、过膜、测定磷浓度.
2.4.3 ph与离子强度影响
配制一系列50 ml浓度为5.0 mg · l-1磷溶液,分别投加200 mg吸附剂,考察不同ph(3.0~11.0)和不同离子强度(0.1 mol · l-1,0.01 mol · l-1,0.001 mol · l-1 nano3)对吸附磷的影响. 用hno3和naoh调节溶液ph,使ph稳定在不同预定值.
2.4.4 共存离子影响
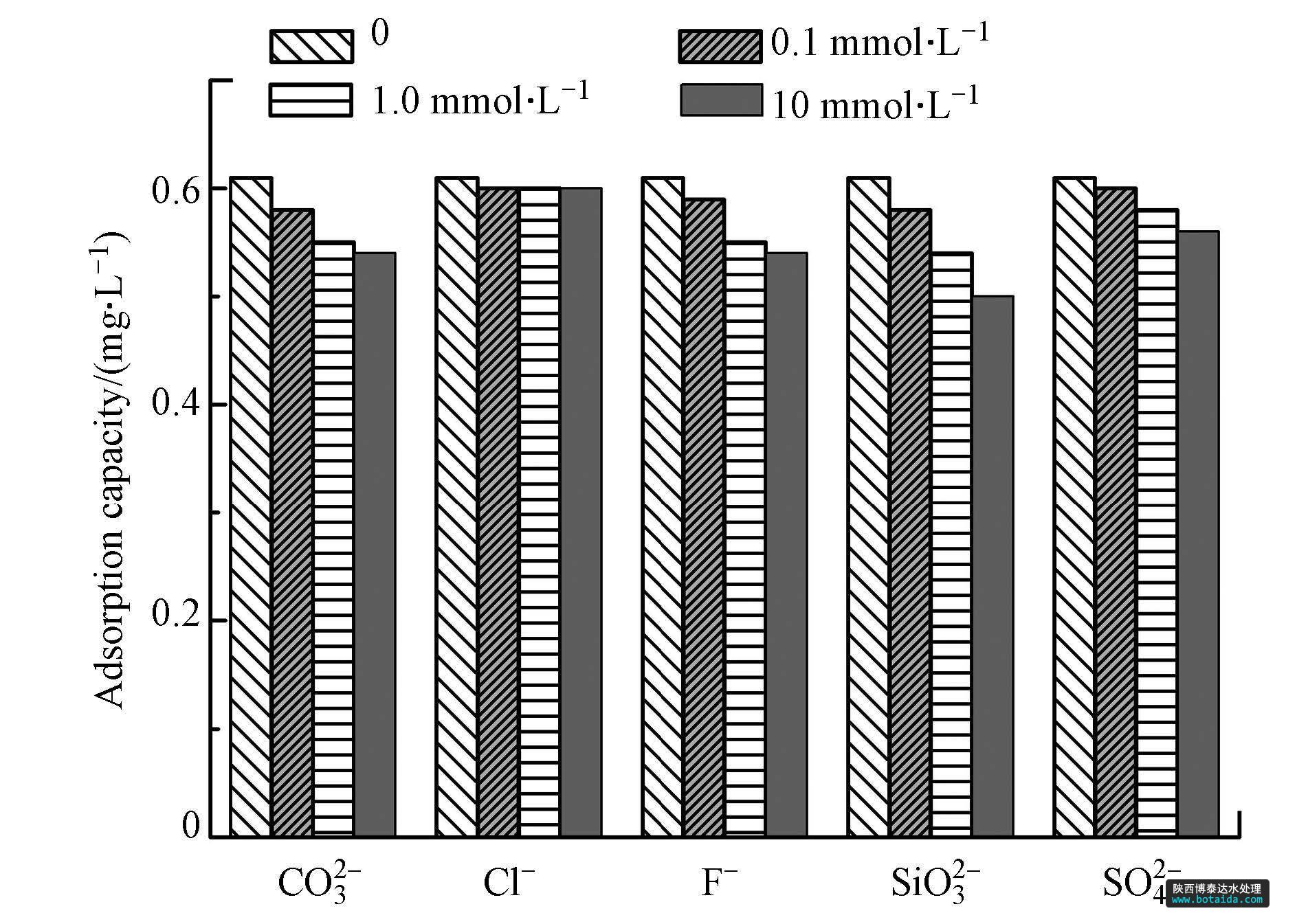
配制一系列50 ml浓度为5.0 mg · l-1磷溶液,溶液ph 7.0±0.1,分别投加200 mg吸附剂,考察cl-、f-、co32-、so42-与sio32- 5种阴离子在4种不同浓度(0 mmol · l-1,0.1 mmol · l-1,1.0 mmol · l-1,10 mmol · l-1)时对吸附磷的影响.
2.5 数据分析 2.5.1 磷吸附量计算
磷吸附量q按式(1)计算:
式中,q为磷吸附量(mg · g-1),v为磷溶液体积(l),c0和ct分别为溶液初始和t时刻磷浓度(mg · l-1),平衡时ct即为ce, m为吸附剂投加量(g).
2.5.2 吸附等温线模型拟合
对磷吸附结果分别用langmuir模型式(2)与freundlich模型式(3)进行拟合.
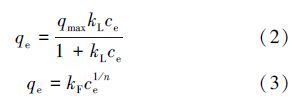
其中,qe为吸附平衡吸附量(mg · g-1),qmax为吸附剂饱和吸附量(mg · g-1),ce为平衡时溶液中剩余磷浓度(mg · l-1),kl为与热力学有关的常数(l · mg-1),kf为与吸附强度有关的常数(l · g-1),n为与吸附能力有关的常数.
2.5.3 吸附动力学模型拟合
磷吸附动力学分别采用准一级动力学模型式(4)和准二级动力学模型式(5)进行拟合.
(1)准一级动力学模型
准一级动力学模型基于假定吸附受扩散步骤控制,吸附速率正比于平衡吸附量与t时刻吸附量的差值,其速率方程为:
(2)准二级动力学模型
准二级动力学模型基于假定吸附速率受化学吸附机理的控制,该机理涉及到吸附剂与吸附质之间的电子共用或电子转移.
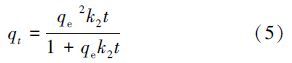
式中,qt和qe分别为t时刻和平衡态时的吸附量(mg · g-1),k1为准一级吸附速率常数(h-1),k2为准二级吸附速率常数(g · mg-1 · h-1).
3 结果和讨论
3.1 铁锰复合氧化物包覆海砂的表征
3.1.1 铁锰复合氧化物的含量
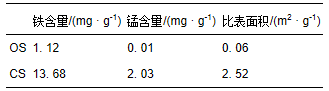
海砂包覆前后的铁、锰含量以及比表面积如表 1所示,铁锰复合氧化物包覆后海砂的铁与锰含量为13.68 mg · g-1与 2.03 mg · g-1,且铁与锰物质的量比符合铁锰复合氧化物制备过程中的二者的比例,依此计算铁锰复合氧化物占包覆海砂的质量分数约为2.5%,高于文献报道的针铁矿包覆石英砂的针铁矿含量1.9%与赤铁矿包覆石英砂的赤铁矿含量1.0%(rusch et al., 2010). 包覆后海砂的bet比表面积增大,由0.06 m2 · g-1增至2.52 m2 · g-1,为磷的吸附提供更多的吸附位点.
表1 海砂与包覆海砂的铁锰含量及比表面积
3.1.2 sem表征
铁锰复合氧化物包覆前后海砂的扫描电镜sem照片如图 1所示,包覆前海砂(图 1中a与b)的表面光洁,均匀平滑,而包覆后海砂(图 1中c与d)的表面是由纳米级的球状或片状颗粒紧密且杂乱无序的团聚在一起,表面凹凸不平,大小不均,为多孔状结构,这与包覆后海砂的bet比表面积显著增大相一致.
图1 海砂与包覆海砂的扫描电镜照片(a. 海砂×100倍; b. 海砂×10000倍; c. 包覆海砂×100倍; d. 包覆海砂×10000倍)
3.1.3 edax表征
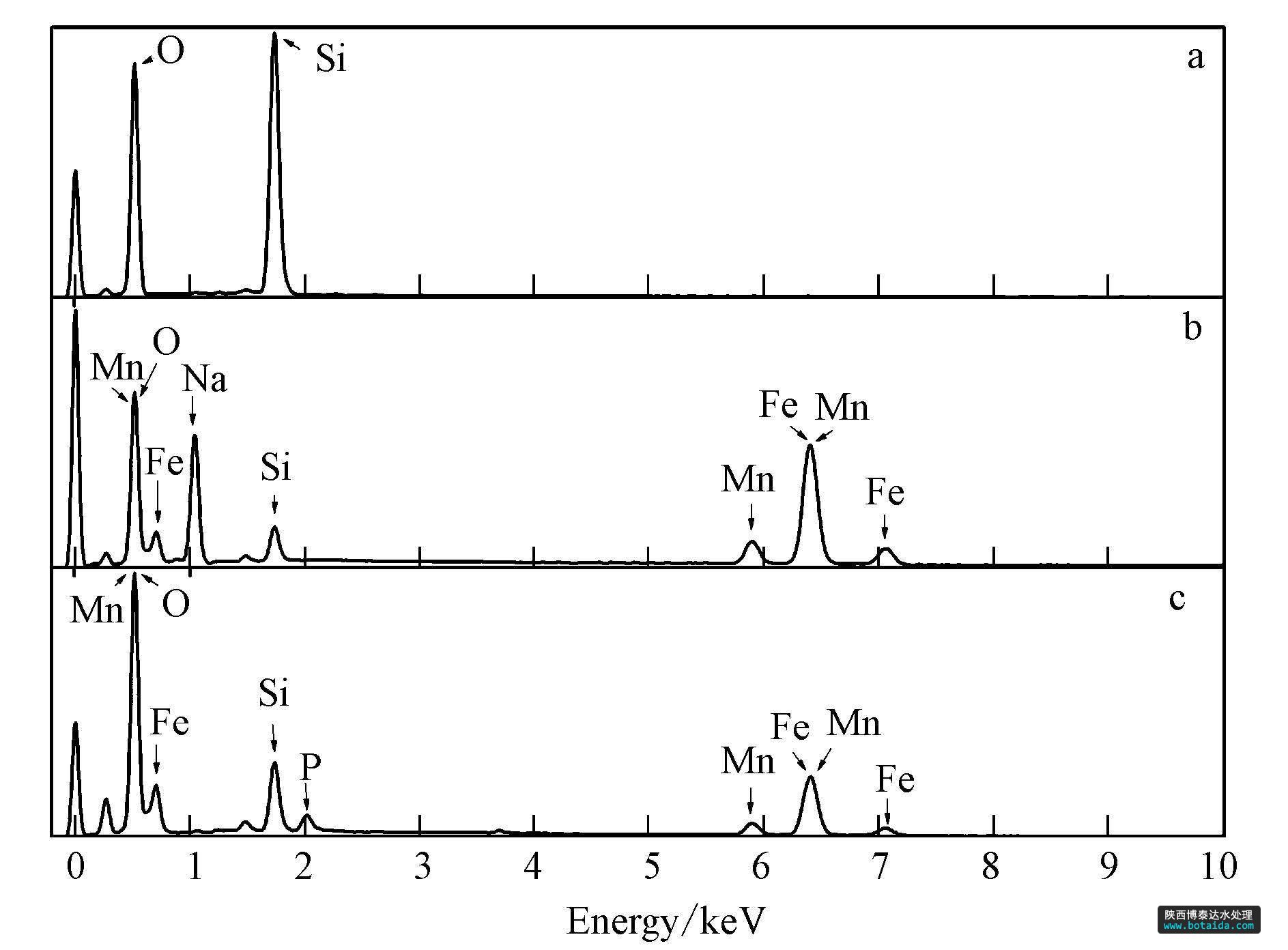
海砂与包覆海砂磷吸附前后的edax图谱如图 2所示. 海砂以硅元素与氧元素为主要成分,包覆铁锰复合氧化物后,出现了明显的铁元素与锰元素的特征峰,表明铁锰复合氧化物包覆在海砂的表面. 吸附磷后包覆海砂的edax图谱又出现了磷元素的特征峰,表明铁锰复合氧化物包覆海砂对溶液中的磷具有吸附性能.
图2 海砂与包覆海砂吸附磷前后的edax图谱(a. 海砂; b. 吸附磷前的包覆海砂; c. 吸附磷后的包覆海砂)
3.2 吸附等温线
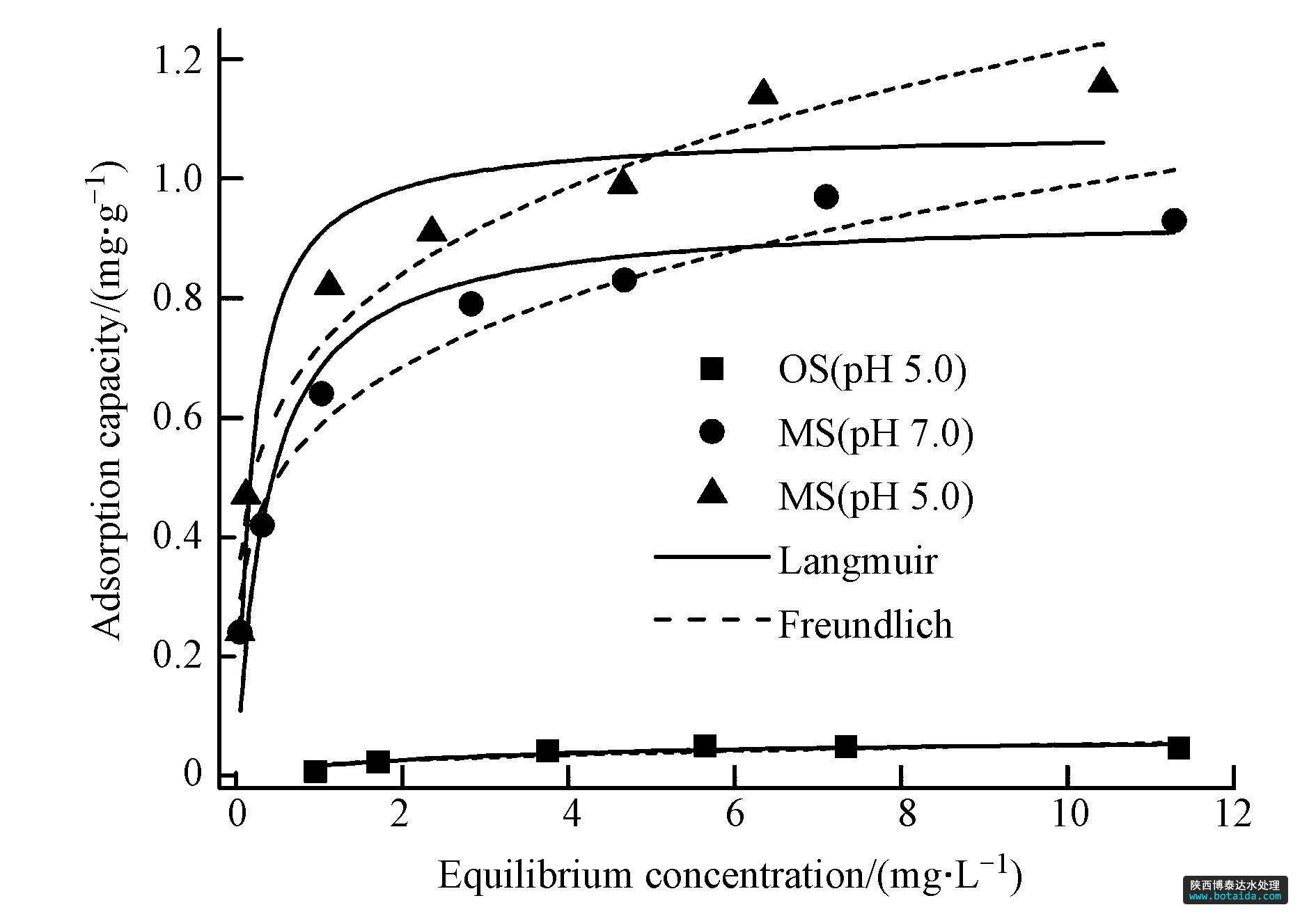
图 3为海砂与包覆海砂在溶液ph为7.0与5.0条件下对磷的吸附等温线. 海砂对溶液中磷的吸附能力很低,铁锰复合氧化物包覆后海砂对溶液中磷的吸附明显增强,吸附量随着平衡浓度的升高逐渐增大,在低平衡浓度时吸附量增加较为迅速,当平衡浓度进一步增大,吸附量增加缓慢,趋于饱和.
图3 海砂与包覆海砂对磷的吸附等温线(溶液体积=50 ml,转速=200 r · min-1,吸附剂投加量=200 mg,ph=7.0±0.1,ph=5.0±0.1,磷初始浓度(0~20 mg · l-1),平衡时间=24 h,t=(25±1)℃
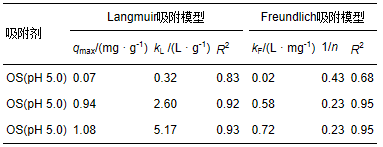
分别采用langmuir 吸附模型与freundlich 吸附模型进行拟合,结果见表 4. freundlich吸附模型的拟合结果r2为0.95(ph 7.0)与0.95(ph 5.0)大于langmuir吸附模型拟结果r2为0.92(ph 7.0)与0.93(ph 5.0),表明freundlich吸附模型更适合描述包覆海砂对磷的吸附行为,与铁锰复合氧化物的磷吸附等温线拟合模型相一致(zhang et al., 2009).
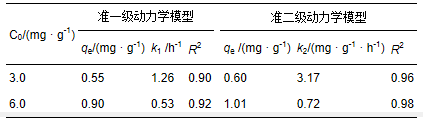
表4 包覆海砂对磷的吸附动力学拟合参数
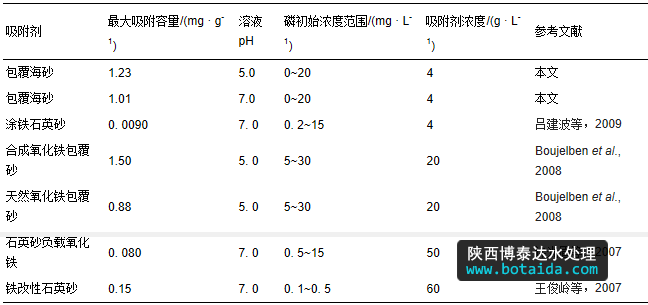
基于freundlich吸附模型的假定条件推断,包覆海砂对磷的吸附为多分子层吸附,最大吸附容量为1.01 mg · g-1(ph 7.0)与1.23 mg · g-1(ph 5.0),比包覆前海砂的磷最大吸附容量0.07 mg · g-1(ph 5.0)提高了13~17倍. 根据包覆海砂中铁锰复合氧化物的含量为2.5%,计算包覆海砂的铁锰复合氧化物的磷最大吸附容量为37.6 mg · g-1(ph 7.0)与46.4 mg · g-1(ph 5.0),显著高于前期研究中粉末状铁锰复合氧化物的磷最大吸附容量36 mg · g-1(ph 5.6)(zhang et al., 2009),表明铁锰复合氧化物包覆海砂不仅能实现铁锰复合氧化物的固定化,易于填充在吸附柱或吸附罐内用于污水除磷,而且能充分发挥粉末状铁锰复合氧化物的磷吸附性能. 此外,与文献中报道的负载改性砂颗粒吸附剂相比(见表 3),铁锰复合氧化物包覆海砂具有较强的磷吸附优势.
表2 海砂与包覆海砂的langmuir和freundlich吸附等温线拟合结果
表3 文献报道的负载改性砂吸附剂的磷吸附效果
3.3 吸附动力学
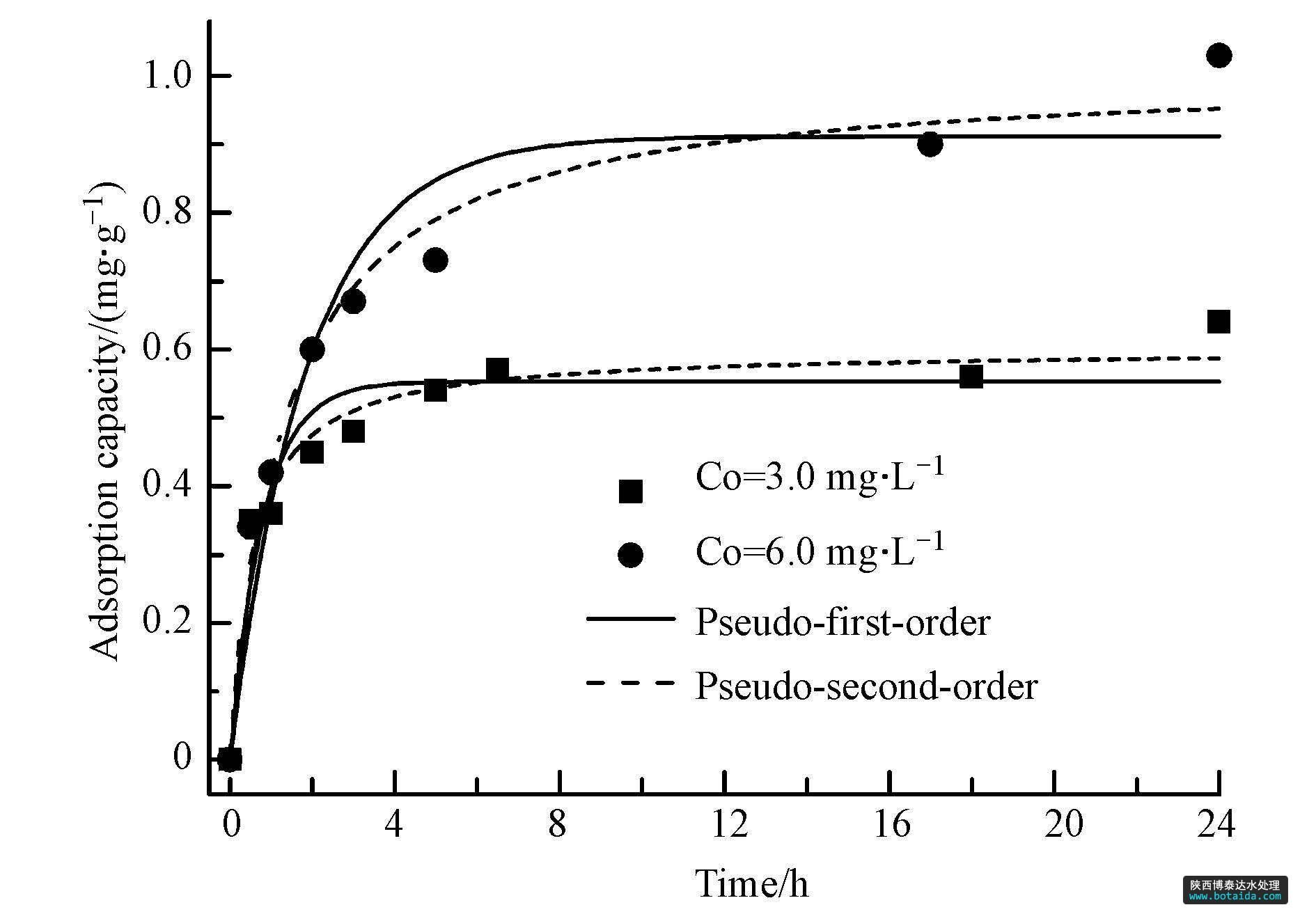
由图 4可知,铁锰复合氧化物包覆海砂对磷的吸附可以分为两个阶段: 快速阶段(0~3 h)与慢速阶段(3~24 h). 在初始阶段,磷吸附速率较快,吸附量随时间迅速增加,这是由于吸附初期包覆海砂表面的吸附位点较多,液相与包覆海砂表面的离子浓度差较大,磷容易扩散到包覆海砂表面被吸附. 随着吸附的进行,吸附点位逐渐饱和,吸附进入慢速阶段,吸附速率逐渐放缓,直至吸附平衡.
图4 包覆海砂对磷的吸附动力学(磷初始浓度分别为6.0 mg · l-1和3.0 mg · l-1,溶液体积=1.0 l,吸附剂投加量=4 g,ph=5.0±0.1,转速=200 r · min-1,t=(25±1)℃,平衡时间=24 h)
分别采用准一级和准二级动力学模型对两种不同磷初始浓度的吸附过程进行拟合,拟合曲线及拟合参数分别见图 4及表 4. 准二级模型的系数(r2=0.96,c0=3.0 mg · l-1; r2=0.98,c0=6.0 mg · l-1)均高于准一级模型的系数(r2=0.90,c0=3.0 mg · l-1; r2=0.92,c0=6.0 mg · l-1),说明吸附过程更符合准二级吸附动力学模型,推测磷在包覆海砂的表面发生了化学吸附.
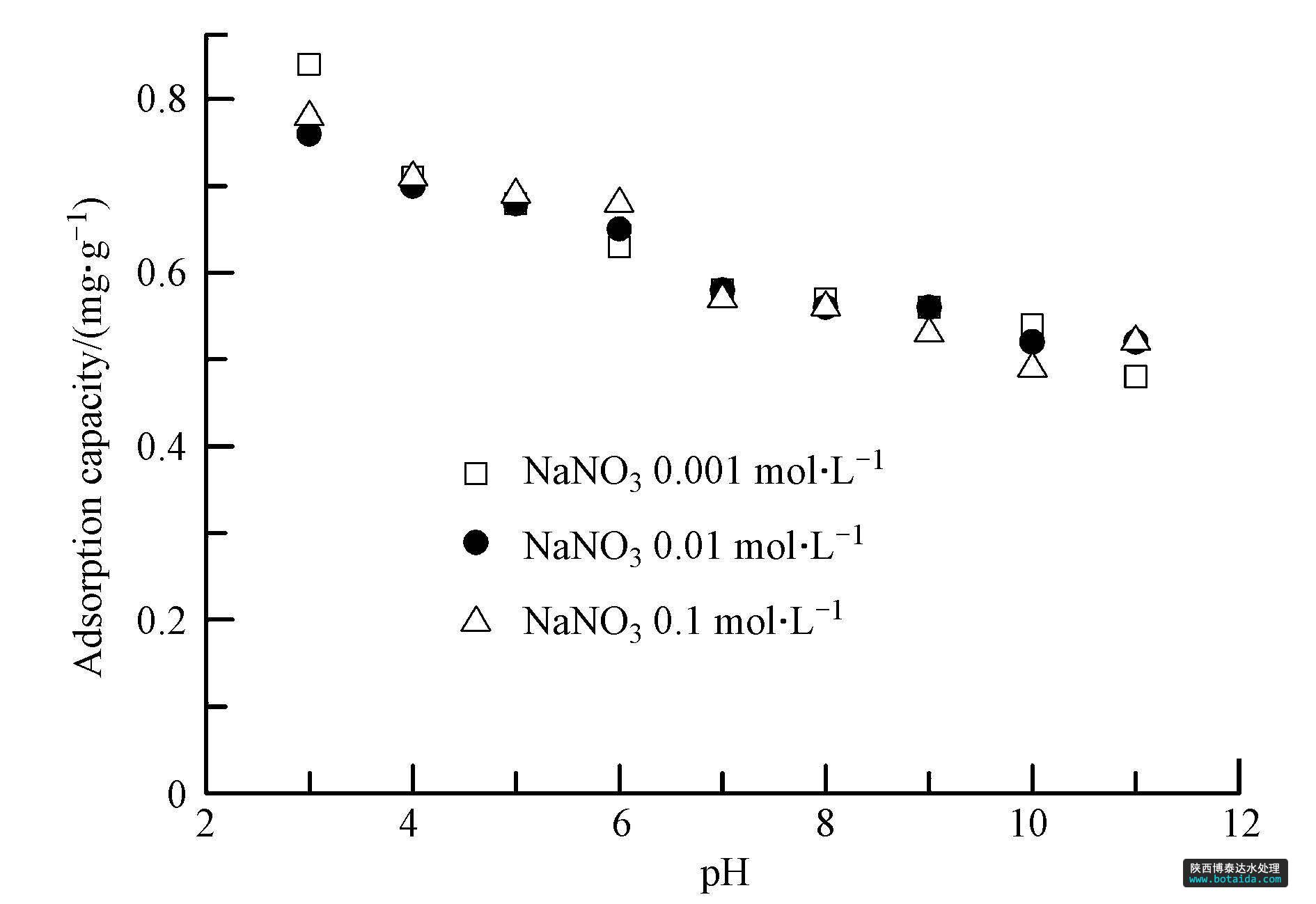
3.4 ph与离子强度对磷吸附的影响
溶液ph与离子强度对包覆海砂吸附磷的影响如图 5所示. 包覆海砂的磷吸附效果受到溶液ph的影响,随着溶液ph值升高,磷的吸附容量逐渐降低,但是降低的幅度不大. 当溶液ph值3.0时,磷吸附容量为0.79 mg · g-1,而ph值升至11.0时,包覆海砂仍保持了较高的磷吸附容量,为0.51 mg · g-1,说明包覆海砂作为磷吸附剂适用的ph值范围较广. 溶液离子强度的变化对磷吸附效果则影响不大,推断磷在铁锰复合氧化物包覆海砂表面形成了内层表面络合物.
图5 ph值与离子强度对包覆海砂吸附磷的影响(磷的初始浓度=5.0 mg · l-1,溶液体积=50 ml,吸附剂投加量=200 mg,转速=200 r · min-1,t=(25±1)℃,平衡时间=24 h)
3.5 共存离子对磷吸附的影响
水体中常见阴离子co32-、cl-、f-、so42-及sio32-对包覆海砂吸附磷的影响如图 6所示. cl-与so42-对磷吸附效果的影响较小; co32-与f-的存在略微抑制了磷吸附,即使二者的浓度升至10 mmol · l-1时,磷吸附容量仍维持在对照实验值的90%以上; sio32-对磷的去除有一定影响,且随浓度增高影响增大,可能由于硅与磷位于元素周期表中同一周期的相邻位置,且sio32-与po32-的形态相似,在包覆海砂表面的吸附活性点位产生竞争吸附,导致磷吸附容量降低. 考察的5种共存阴离子对磷吸附的影响顺序为sio32-> co32- >f- >so42- > cl-,总体上讲,包覆海砂对中磷的吸附具有较好的选择性.
图6 共存离子对包覆海砂吸附磷的影响(磷的初始浓度=5.0 mg · l-1,溶液体积=50 ml,吸附剂投加量=200 mg,ph=7.0±0.1,转速=200 r · min-1,t=(25±1)℃,平衡时间=24 h)
4 结论
1)通过对包覆海砂的sem、bet比表面积、edax及表面铁锰含量的表征研究,表明铁锰复合氧化物成功包覆在海砂的表面,实现了粉末状铁锰复合氧化吸附剂的固定化.
2)包覆海砂能够充分发挥铁锰复合氧化物的磷吸附性能,吸附能力显著提高,最大磷吸附容量为1.01~1.23 mg · g-1,优于多数文献报道的负载改性砂颗粒吸附剂; 对磷的吸附速率较快,较符合准二级动力学模型,推测磷在包覆海砂表面发生了化学吸附.
3)溶液ph影响磷的吸附,但降低的幅度不大,在较宽的ph范围仍具有较高的磷吸附容量; 离子强度则影响不大,推断磷在包覆海砂表面可能形成了内层表面络合物; 共存离子的影响表明,包覆海砂对磷的吸附具有较好的选择性.
4)本研究铁锰复合氧化物包覆海砂颗粒吸附剂的制备方法简单,磷吸附效率高,且海砂丰富价廉,为工业化大规模的生产以及在吸附罐等连续流动污水除磷工艺中的应用提供了可行性.