近些年,藻类水华事件常有报道.其中,硅藻水华自1992年春季在我国汉江下游爆发后,几乎每年春季汉江中下游江段均会暴发不同程度的水华.2005—2011年,嘉陵江流域间断性爆发硅藻水华,70%~80%的藻类属于针杆藻,水体浑浊,溶解氧降低,对水源质量造成了巨大的破坏;且水厂出现硅藻严重堵塞滤池的现象,导致量减小,出厂水质变差.
目前除了常规的物理除藻方法,研究最多的是化学控藻技术.daly等研究铜绿微囊藻最高细胞密度为30×104 cells · ml-1时,氯作用在7~29 mg · min · l-1 之间(在水厂正常的消毒剂量范围内),所有藻细胞失活;但是已经有大量的研究证明氯法杀藻会引起水中三卤甲烷(thms)等消毒副产物的产生,因此该方法已经正在逐渐被其他除藻药剂代替.chen等研究了高锰酸钾预氧化能很好提高絮凝对藻去除率的机理,而petrusěvski 等的研究也指出高锰酸盐的使用剂量与残余锰量是呈正相关的,因此发生水华时投加高锰酸盐很有可能会造成水源中锰超标,硫酸铜的使用也有此类问题.刘海龙等用1.0 mg · l-1的臭氧预氧化使藻的去除率从常规混凝沉淀后水的55%~85%上升到95%左右,但高投加量(≥2.0 mg · l-1)的预氧化,会影响有机物的去除;coral等研究直接使用臭氧作用于细胞密度为25×104和150×104 cells · ml-1 的铜绿微囊藻藻液,在作用ct值都小于0.2 mg · min · l-1 时,所有细胞即失活;可看出臭氧除藻的效果很好,但是存在的问题是制备臭氧的设备成本很高,在国内很难应用于实践.huang等从剂量、接触时间和ph值等方面研究表明二氧化氯对藻的去除效果优于或等同于液氯的去除效果;zhou等研究将二氧化氯直接作用细胞密度为100×104 cells · ml-1铜绿微囊藻,在二氧化氯浓度1.0 mg · l-1作用10 min,藻细胞去除率达到91.5%.
目前我国关于除藻技术的研究以蓝藻为主,较少有硅藻杀灭的研究,因此本文以硅藻门中的针杆藻为例,利用大气压强电离放电高效生成的· oh,注入到处理高藻水的主管路中,进行水华典型藻针杆藻的杀灭研究.采用以sytox green荧光染色结合荧光显微镜和流式细胞仪检测藻细胞活性、光合活性参数fv/fm值分析藻细胞光合能力,这3种方法来确定· oh致死针杆藻的阈值浓度和阈值浓度下的致死时间.
2 材料和方法
2.1 实验材料
藻种及培养:实验所用的藻种购自中科院武汉水生所.针杆藻(fachb-843,synedra sp.):属硅藻门羽纹纲无壳缝目,细胞长杆形,长10 μm左右,壳面披针形,中部宽,从中间到两端逐渐狭窄;色素体带状,位于细胞的两侧、片状,2个,每个色素体常具有3个到多个蛋白核.培养基为erdschreiber,培养条件为(25±1)℃,ph=7.0±0.1,光照2000 lx,光期 ∶ 暗期=12 ∶ 12.利用显微镜计数对藻细胞密度进行监测,同时测吸光度,待进入对数生长期,进行实验.
实验用水是由纯水机制备的去离子水,用于调节系统参数制备所需浓度的tro溶液和配制藻液.
2.2 实验系统
· oh处理高藻水的实验系统如图 1所示.待处理藻液由水泵泵入管路,进水流量为4 l · min2-1,纯度为99.9%的o2通入氧等离子体发生器中(图 2),流量为0.5 l · min-1.在大气压下微流注与微辉光交替协同形成的强电离放电作用下,o2被电离,生成o 、o(21d)、o、o-、o2(a21δg)、o3等氧活性粒子;然后在高压射流器处,经射流、空穴作用将气态氧活性粒子高效传质混溶于水溶液中,生成以· oh为主的氧自由基溶液,其中还包括h2o2、ho-、o2· -,
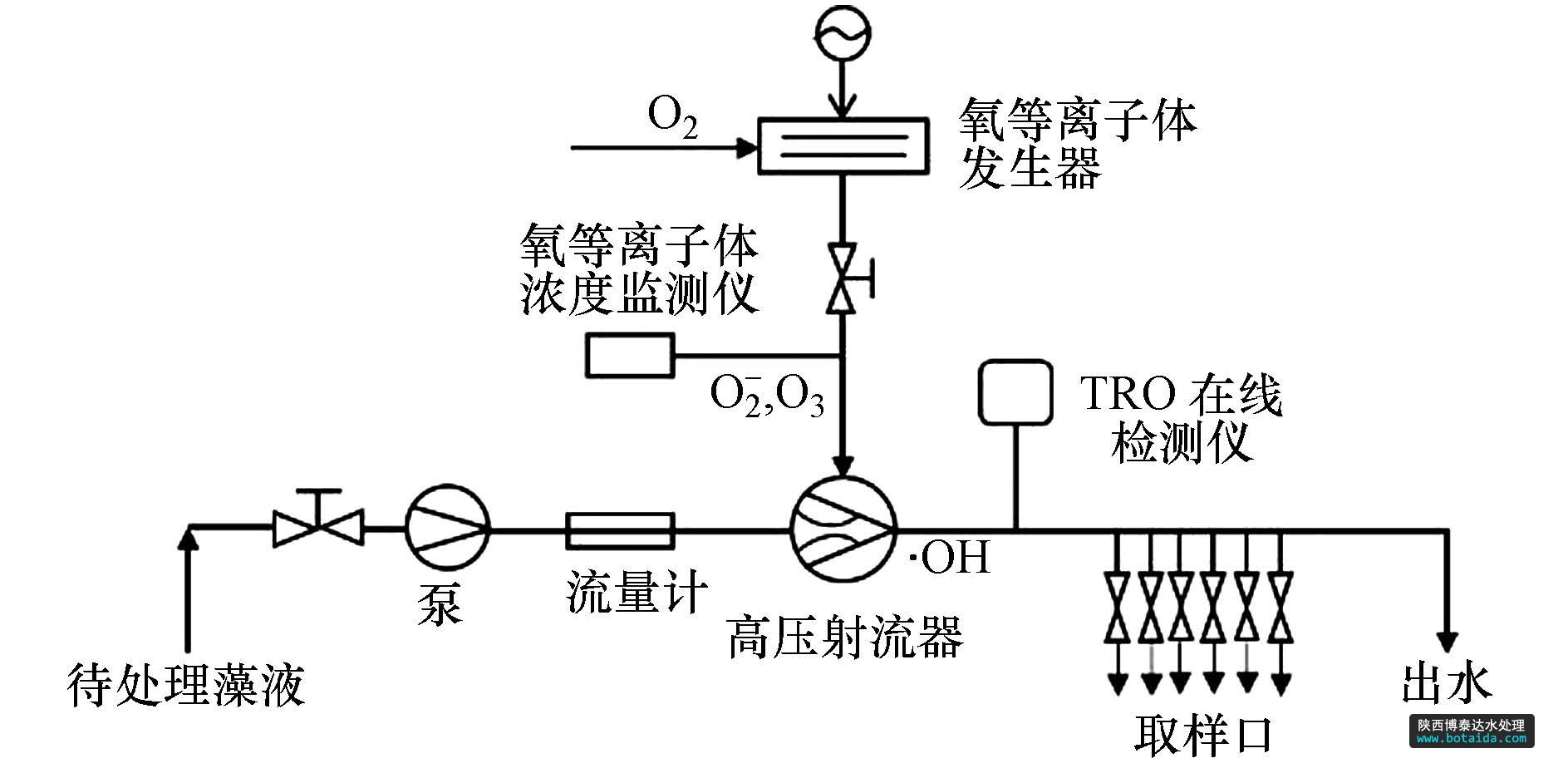
图1 · oh处理高藻水的实验系统
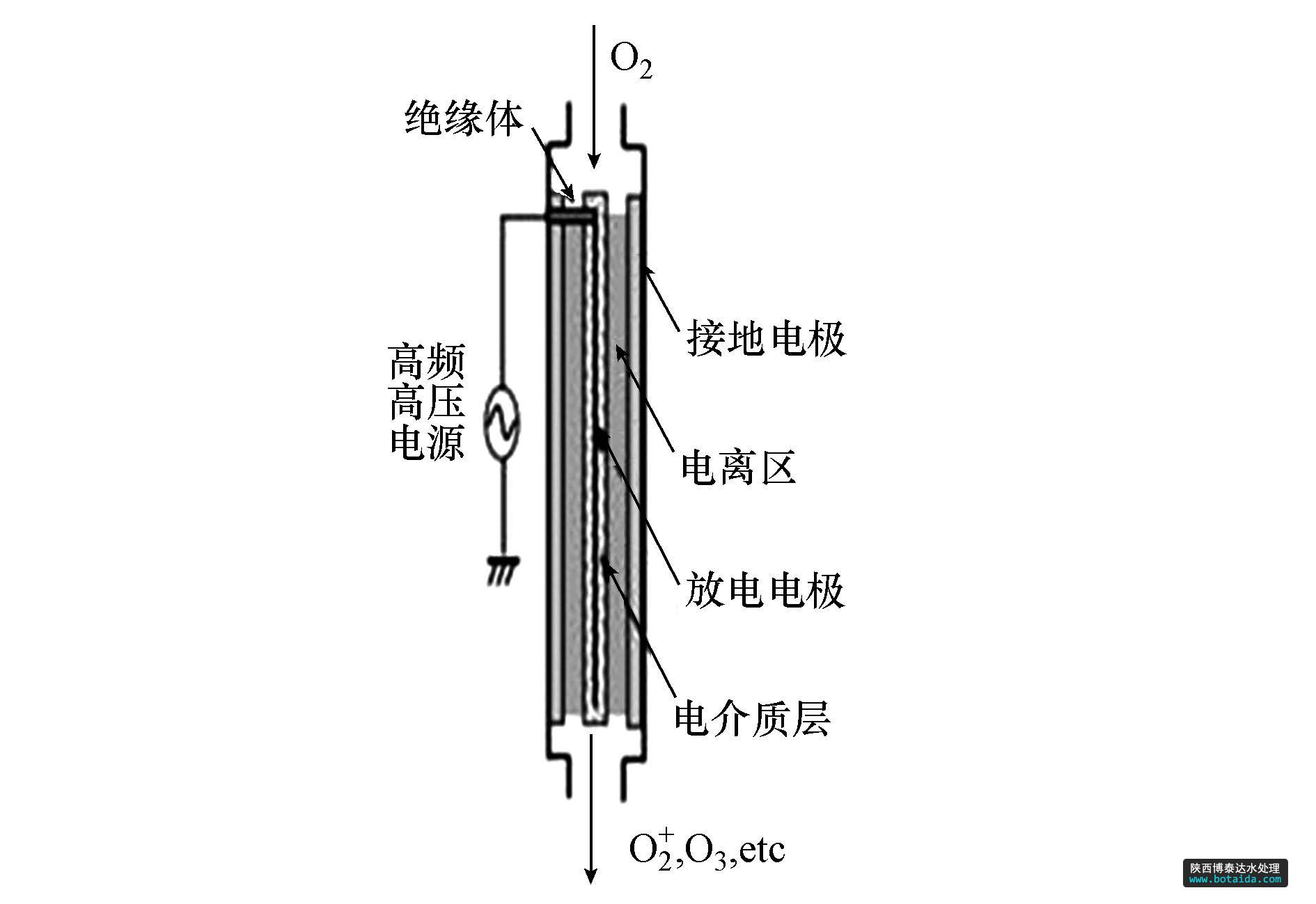
图2 等离子体发生器构造图
o2· -、ho3 ·和o2 h2o等自由基,将这些氧自由基统称为总氧化剂tro,使用在线检测仪(ati q45h,美国)对管路中的tro浓度进行测定.tro溶液在管路中作用于藻细胞,进行快速高效地杀灭.管路中设置不同的取样点,作用时间分别为1、2、3、4、5、6 s,以研究不同作用时间的杀灭效果.
2.3 检测方法
2.3.1 总氧化剂tro(total
reactive oxidant)浓度检测 tro是以· oh为主,包括h2o2、ho2-、o23· -、o· -、ho3 ·和o2 h2o等氧自由基的总氧化剂,使用在线监测仪(ati q45h,美国)对tro浓度进行测定,同时使用dpd(n,n-二乙基对苯二胺)分光光度法对浓度进行校正,该方法根据usepa标准330.5建立,使用紫外可见分光光度仪(bioquest ce2501,英国)测定.
2.3.2 藻细胞活性分析
本实验采用荧光染色法结合荧光显微镜计数和流式细胞仪来定量分析藻细胞活性,这些方法已广泛应用于分析细菌、胞子和藻细胞活性.荧光染料为sytox green(life technologies,美国)核酸染色剂,当细胞膜受损,染色剂通过细胞膜进入细胞,与dna结合,可在488 nm波长激发后发出绿色荧光;对于活细胞,染色剂不能通过细胞膜而不会被染色.
于暗室内染色,使用荧光显微镜(nikon 90i,日本)和0.100 ml 100格的藻类计数框(20 mm×20 mm),进行观察计数.涂片静置,放大400倍,分别在自然光和蓝色激发光下观察细胞,对没有发出绿色荧光的完整细胞进行计数.以1行(即10格)为1个计数单位进行计数,所计细胞数目≥100 cells.
于暗室内染色,样品经流式细胞仪(beckman coulter gallios,美国)488 nm的波长激发,细胞发出的荧光信号会分别被fl1(525 nm)和fl3(620 nm)通道收集.激发后发出的绿色荧光,在fl1通道被收集;同时细胞内叶绿素发出的红色荧光会被fl3通道收集.
2.3.3 藻细胞的光合能力分析
光合参数fv/fm值,表示藻细胞光合反应中心ps ii的最大光量子产量,反映了植物的最大潜在光合能力.该值越大说明光和潜力越大.样品经10 min的暗适应,使用浮游植物荧光仪(phyto-pam walz,德国)和photo win v2.13(ed)操作软件测定.经过充分暗适应后,所有电子门均处于开放态,打开测量光得到最小荧光f0,此时给出一个饱和脉冲,所有的电子门就都将该用于光合作用的能量转化为了荧光和热,此时得到的最大荧光fm,根据fm和f0可以计算出fv/fm=(fm-f0)/fm.
3 结果与分析 3.1 采用荧光显微镜计数确定致死阈值
实验中对初始藻密度分别为10×104、50×104、100×104 cells · ml-1的藻液在实验系统中进行杀灭.对于某一藻密度的藻液,改变tro浓度,利用荧光显微镜测定藻细胞的存活率(c/c0).得到不同初始藻密度的藻细胞存活率与tro浓度的关系曲线,如图 3所示.可看出,随着tro浓度的不断升高,藻细胞存活率随之降低;在相同的tro浓度下,藻类的初始浓度越高,存活率越低.因此使不同的初始藻密度的藻细胞完全致死所需的tro浓度是不同的.随着藻液初始藻密度的升高,所需要的致死剂量也随之升高.致死剂量由低到高分别为0.25、0.71、1.18 mg · l-1.
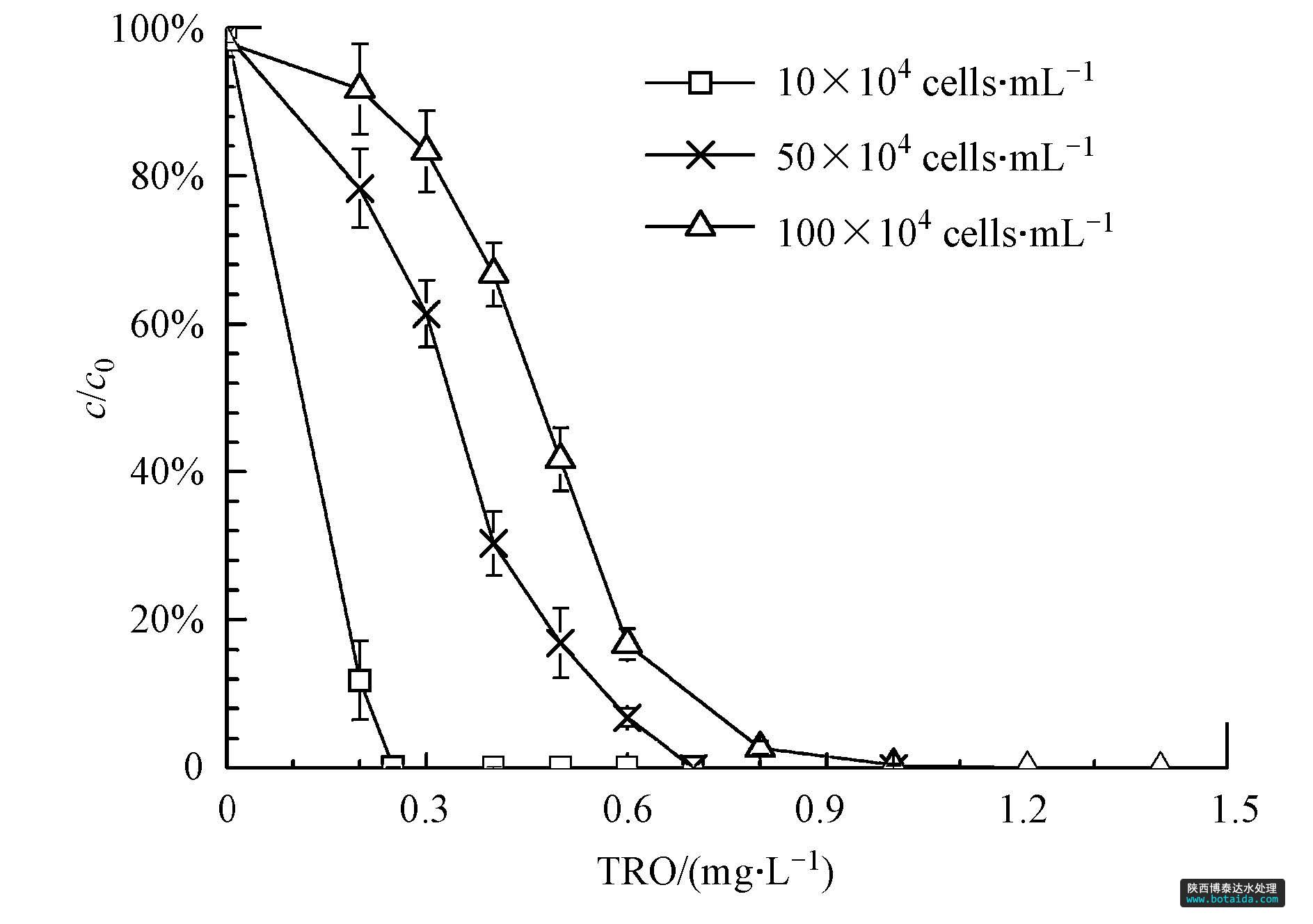
图3 藻细胞存活率(c/c0)与tro浓度的关系曲线
分析比较初始密度增大的倍数与对应的tro致死剂量增大的倍数,发现tro致死剂量增大的倍数均小于初始密度增大的倍数.如初始藻密度10×104 cells · ml-1分别增大到5、10倍,而对应的tro致死剂量明显小于5、10倍.推测溶液中· oh占总氧化剂的比例随tro浓度的增加而增加,从而导致所需的tro剂量相对减少.
初始藻密度为100×104 cells · ml-1的藻液,在致死阈值下经· oh处理.在显微镜下,放大400倍,分析处理前后藻细胞形态的变化.在自然光下,处理前,藻细胞通体周圆,细胞壁光滑完好,胞内结构分布清晰,颜色鲜亮稠密;处理后,藻细胞外形基本没有变化,但颜色暗淡,胞内分布模糊.在荧光下,处理前藻细胞发出红色的叶绿素自体荧光,无绿色荧光;处理后细胞核发出强烈的绿色荧光,证明细胞失活,染色剂通过细胞膜进入细胞,与细胞核中的dna结合,使细胞核染色.
以上现象均可看出在较低的致死阈值作用下,细胞失活后外形没有大的变化,更没有出现裂解.
3.2 采用光合能力确定致死阈值
作为一种自养型生物,硅藻需要自身的光合反应系统,包括光合反应系统ⅰ(psⅰ)和光合反应系统ⅱ(psⅱ)完成能量转换.这种脉冲式调制荧光测定技术(pam)是基于测定叶绿素荧光的原理,是一种表征光合反应系统的性能,特别是psⅱ的活性的强有力的手段.对psⅱ反应中心的损伤不仅会引起光抑制作用,固碳作用受损和生长速率降低.目前已有研究表明利用该方法测得的fv/fm值可作为预测藻类生长趋势的参数.
初始细胞密度分别为10×104、50×104、100×104 cells · ml-1的藻液,测定经过不同tro浓度作用后藻液的光合参数fv/fm值,分析藻细胞光合能力的变化情况,处理前藻液的fv/fm值为0.50左右,处理后随着tro浓度的增大而减小,fv/fm值降低为0,说明此时的藻细胞已经不能进行光合作用,藻细胞已无生长能力.此时的tro浓度即为致死阈值,分别为0.30、0.75、1.20 mg · l-1.
3.3 采用流式细胞技术确定致死阈值浓度
初始藻密度为100×104cells · ml-1,利用流式细胞仪分析不同tro浓度与藻细胞致死情况的关系,横坐标fl1-a对应于染色剂与细胞核酸结合后发出的绿色荧光强度,纵坐标fl3-a对应于叶绿素的自发红色荧光强度.区域q1的fl1信号较弱,而fl3信号较强,说明此区域为活细胞所在区域.比较对照组和处理组,细胞团由区域q1逐渐向右下方即区域q2和q3移动,即绿色荧光增强,叶绿素荧光减弱.证明细胞失活,被sytox green染色,同时叶绿素也遭到破坏.由对照组到tro浓度依次增大为0.61、0.83、1.18 mg · l-1,区域q1的活细胞占全部检测细胞的比例由原始的93.6%依次减小为16.5%、1.21%、0.265%(图 4a~d),说明存活细胞随tro浓度的增大而减少.
3.4 · oh对针杆藻的致死时间探究
分别在致死阈值浓度0.30、0.75、1.20 mg · l-1时,将初始藻密度分别为10×104、50×104、100×104 cells · ml-1的针杆藻藻液通入杀藻实验系统(图 1).将高压射流器处藻液与氧等离子体刚开始混合时,设为0 s,分别依次于不同作用时间(分别为1、2、3、4、5、6 s)的取样口取样,同时用过量的饱和硫代硫酸钠终止反应.检测每一样品的fv/fm值,结果可看出,fv/fm值均在1 s内快速由0.50减小为0(仪器显示为不能检出).说明在高压射流器处到1 s取样口之间,发生了氧等离子体与水分子快速生成· oh并进行剧烈的生化反应.
3.5 讨论
3.5.1 致死阈值的确定
分析3种确定致死阈值的方法,可知用荧光显微镜观察计数比较直观,可得到细胞存活数量,得到的结果比较稳定可靠,致死阈值分别为0.25、0.71、1.18 mg · l-1;而通过光合参数fv/fm值的变化确定的致死阈值(0.30、0.75、1.20 mg · l-1)与显微镜计数确定的致死阈值相差很小,分别为0.05、0.04、0.02 mg · l-1,基本吻合;采用流式细胞仪分析处理前后不同通道接收的荧光强度的变化来确定致死阈值,这种方法存在的问题是,只能得到活细胞的百分比例,无法得知具体的数目,而且结果的准确度与分析者的熟练程度有很大关系.本实验中初始藻密度为100×104 cells · ml-1,在致死阈值1.18 mg · l-1下,使用流式细胞仪分析后,仍有约2560 cells · ml-1的活细胞,由于实验分析方法的局限,无法使致死率达到100%,因此该方法确定的致死阈值要大于使用计数法确定的致死阈值.
3.5.2 ·
oh对针杆藻的杀灭效果 本实验中在致死阈值下,1 s内使光合参数fv/fm由0.50减小为0,使100×104cells · ml-1藻液中的藻细胞失活的ct值约为0.02 mg · min · l-1,li等(li et al., 2014)的研究水力空化作用1 min,产生· oh的浓度为(0.67±0.03)μmol · l-1,立即测定光合参数由0.33降低为0.31,变化很小;ou等的研究结果为kmno4作用2 h,光和潜力由0.45减低到0.07;zhou等的研究结果为2.5 μmol · l-1(即0.4 mg · l-1)cuso4及0.5 mmol · l-1(即17 mg · l-1)h2o2分别作用48 h后,光合参数分别由处理前约0.42减小为约0.05.daly等利用流式细胞仪来定量分析氯对藻细胞的致死率,研究中也发现藻细胞数量增多,致死率达100%时的需氯量也随之增加;氯作用的ct值在7 mg · min · l-1以上,可使30×104 cells · ml-1的铜绿微囊藻藻细胞完全致死;zhou等的研究中发现可使100×104 cells · ml-1的铜绿微囊藻藻细胞在1 mg · l-1的二氧化氯作用10 min后(ct值约为10 mg · min · l-1)致死率达到91.5%.相比之下,本实验条件下得到的反应时间是其他普通氧化剂的1/60以下,ct值为其他氧化剂的1/100以下,说明· oh有强烈的氧化性和极高的氧化反应速率,其氧化还原电位(2.8 v)接近氟的氧化还原电位,反应无选择性;而且反应速率高达109 mol · l-1 · s-1,比其他氧化剂的高107倍,可使生化反应在ms级内进行.
4 结论
1)初始藻密度分别为10×104、50×104和100×104 cells · ml-1的藻液,采用荧光显微镜计数和光合能力的变化确定的致死阈值分别为0.25、0.71、1.18 mg · l-1及0.30、0.75、1.20 mg · l-1,分别相差0.05、0.04、0.02 mg · l-1,基本吻合.而采用流式细胞仪分析确定致死阈值时,无法使致死率达到100%,因此无法确定致死阈值.
2)在致死阈值下,光合参数fv/fm值1 s内减小为0,藻细胞丧失光合能力和生长潜力.